本文以制作豆腐为真实情境设计并实施“豆腐制作中的点卤剂”探究式教学,通过设置“探究课堂中点卤用的盐类凝固剂成分”“设计制取氯化镁的方案并完善海水中提取氯化镁的方案”和“分析不同盐类凝固剂制作的豆腐应用价值”三项学习任务,完成盐类章节的复习,建构“盐的化学性质”乃至“酸,碱 南宫体育,盐”的知识体系。

1 教学背景
1.1 知识结构化的需要
“盐”复习课选自人教版九年级化学下册第十一单元“盐化肥”,在新授课中学生已认识盐的概念,了解氯化钠,碳酸钙,碳酸钠等常见的盐在日常生产生活中的应用,以及化肥在农业生产中的作用,作为一节复习课,不仅需要让学生掌握盐的化学性质,更应该将碎片化的知识建立关联,通过“复分解反应”这一桥梁,建立起结构化的“酸,碱,盐”知识体系 南宫体育。
1.2 学段衔接的需要
《义务教育化学课程标准(2022年版)》(下文简称“化学新课标”)提出“要加强学段衔接”“合理安排不同学段内容,体现学习目标的连续性和进阶性”“了解高中阶段学科特色 南宫体育,为学生进一步学习做好准备”,初中化学对于“复分解反应能否发生”局限于两种化合物互相交换成分生成水,气体或沉淀,而高中阶段的复分解反应实际上是两种电解质互相交换离子的反应,复分解反应能否发生,进行到什么程度,要通过平衡常数定量分析,因此在复习课中对复分解反应的概念可作适当的延伸,有助于衔接高中教学。
2 设计思路
本课题对应化学新课标中“物质的性质与应用”和“物质的化学变化”两大学习主题,利用化学变化围绕盐类物质进行检验,制取,应用,真正理解盐的化学性质和复分解反应的实质,学会调控化学反应实现物质转化,认识到物质性质和应用之间的关系,选取生活中常见的黄豆制作豆腐为教学情境,“点卤”操作中选择不同凝固剂可制成不同的豆腐,其中常用的盐类凝固剂有和,学生在自制豆腐时会对所用盐类凝固剂成分产生好奇,通过物质鉴别与实验探究得出选用的盐类凝固剂为,该过程复习了盐的化学性质,更深入理解复分解反应,并归纳得出物质检验的一般思路与方法,在此基础上,学生根据所学知识,设计多种制取凝固剂的方案,涵盖了盐的化学性质复习,实际工业生产中利用海水提取氯化镁的方法较多,如有氢氧化钠法和氢氧化钙法等,教师适时提供文献资料 南宫体育,引导学生打破思维定势,多角度发散,从离子角度理解复分解反应,利用盐的化学性质对不同的工艺方案进行探究,反思,评价,在对文献具体实验数据的分析归纳中选择最佳反应条件,得到最佳实验方案,形成证据意识,提升思维能力,学生在真实情境中对知识重组,应用和升华,感受盐在生产生活中的应用价值,体会化学学科的魅力。
3 教学目标
(1)能根据盐的性质对盐类凝固剂成分进行实验探究,建立混合物体系中物质鉴别的方法模型 南宫体育,并建构盐的化学性质的知识结构。
(2)能够利用盐的化学性质和复分解反应等相关知识,分析解决工业生产中的问题,初步形成工程意识和条件控制意识 南宫体育。
(3)能将化学知识与生产生活相联系,动手实践,体悟化学学科在资源利用和创造美好生活中的价值 南宫体育。
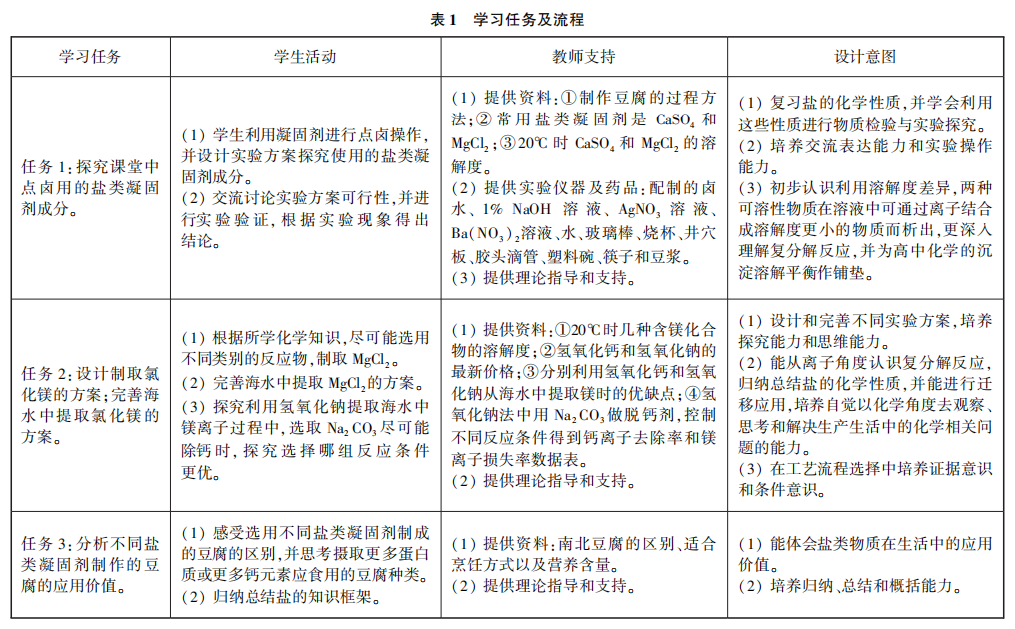
4 学习任务及教学流程
学习任务及教学流程见表1。
5 实施过程及学习成果
[播放视频]课前播放视频《舌尖上的中国(第一季)》第三集:转化的灵感(部分)。
[创设情境]黄豆是我们生活中常见的豆类,视频中在石膏凝固剂的作用下,让黄豆得到了升华成为美味的豆腐,石膏的成分是硫酸钙,同学们 南宫体育,硫酸钙在化学上属于什么物质类别呢。
[学生回答]盐。
[引入课题]今天我们就一起利用盐作凝固剂来制作豆腐,感受其中的奥秘 南宫体育。
5 南宫体育. 1 固“豆”有盐:探究点卤用凝固剂的成分.
[展示制作过程]老师自己在家用新鲜黄豆制作了一份豆腐,我们一起来看一下制作流程(见图1)。

①泡豆,使豆泡发;
②磨浆,制豆浆;
③滤渣,豆渣不要扔,用来做饼;
④过滤出来的豆浆放入锅中加热煮沸5分钟左右,转小火再煮5分钟后关火,除去浮渣;
⑤等豆浆冷却至80℃左右,进行点卤,这一步至关重要。凝固剂有不同种类,选择想要的凝固剂,将其加入到豆浆中,使蛋白质凝聚沉降;
⑥最后将其放入模具制成豆腐。
[互动]今天,老师想邀请同学们一起完成最重要的一步—点卤。同学们的桌子上有配好的卤水,要边用筷子搅拌边加入卤水,搅拌速度要慢,不要有水花。当豆浆内出现一半的豆花时,就停止加卤水,停止搅拌,盖上盖子,静置15~20分钟。
[学生活动]用事先煮好的热豆浆进行点卤操作。
[提问]同学们,我们刚刚所加的卤水,是老师用这包凝固剂配制而成的。常用的盐类凝固剂除了课前视频中的石膏粉(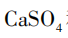 ),还有盐卤(
),还有盐卤(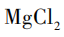 )。我们怎么才能知道刚刚用的是哪一种凝固剂呢?请同学们小组讨论,如何设计实验检验?
)。我们怎么才能知道刚刚用的是哪一种凝固剂呢?请同学们小组讨论,如何设计实验检验?
[学生活动]展示实验方案:A小组提出滴加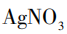 溶液,如果有氯化镁,就会发生复分解反应:
溶液,如果有氯化镁,就会发生复分解反应: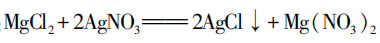 ,产生白色沉淀。
,产生白色沉淀。
B小组提出滴加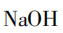 溶液,如果有氯化镁,就会发生复分解反应:
溶液,如果有氯化镁,就会发生复分解反应: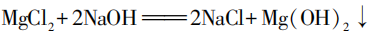 ,产生白色沉淀。
,产生白色沉淀。
C小组提出滴加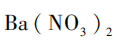 溶液,如果有硫酸钙,就会发生复分解反应:
溶液,如果有硫酸钙,就会发生复分解反应: ,产生白色沉淀。
,产生白色沉淀。
[对各方案的评价]师生逐一研讨A、B、C三个小组的方案是否可行。
A小组方案:有学生认为不可行,因为硫酸银微溶于水,浓度大了也是沉淀。
B小组方案:有学生认为不可行,因为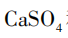 和NaOH溶液也可以生成溶解度更低的
和NaOH溶液也可以生成溶解度更低的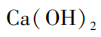 ,浓度高时
,浓度高时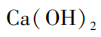 便会析出。但也有学生结合澄清石灰水的经验,认为
便会析出。但也有学生结合澄清石灰水的经验,认为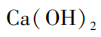 仍然有一定的溶解度,当它浓度较低时未必会析出。因此他们完成了如图2所示的实验,向室温下等量饱和
仍然有一定的溶解度,当它浓度较低时未必会析出。因此他们完成了如图2所示的实验,向室温下等量饱和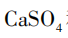 溶液滴加20滴不同浓度的NaOH溶液,通过实验发现,1%的NaOH溶液遇
溶液滴加20滴不同浓度的NaOH溶液,通过实验发现,1%的NaOH溶液遇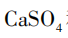 无明显现象,不干扰实验。
无明显现象,不干扰实验。
C小组方案:利用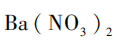 溶液的不会有干扰现象,这个方法最好。
溶液的不会有干扰现象,这个方法最好。
[小结]可用多种方法解决同一个问题。利用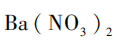 溶液最没有争议,但若是改变NaOH溶液和
溶液最没有争议,但若是改变NaOH溶液和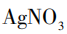 溶液的浓度,同样也可以防止干扰实验现象。
溶液的浓度,同样也可以防止干扰实验现象。
[学生实验]将用凝固剂配制的卤水分别加入井穴板三个卡槽内,分别滴入1%NaOH溶液、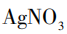 溶液、
溶液、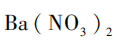 溶液,观察实验现象。
溶液,观察实验现象。
[观察现象]滴入1%NaOH溶液和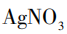 溶液后的卡槽内均有白色沉淀产生,滴入
溶液后的卡槽内均有白色沉淀产生,滴入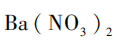 溶液的卡槽内无白色沉淀产生。
溶液的卡槽内无白色沉淀产生。
[得出结论]用的凝固剂是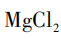 。
。
[整理归纳]上述实验,可以归纳出盐的主要性质:盐+盐→新盐+新盐(A、C组);盐+碱→新盐+新碱(B组)。
[拓展]同学们用自己想出的方案解决了问题,现在老师再补充一个信息:20℃时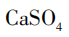 溶解度是0.255g,
溶解度是0.255g,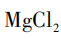 溶解度是54.6g。你还能设计出其他的实验方案吗?
溶解度是54.6g。你还能设计出其他的实验方案吗?
[学生活动]学生用溶解度差异,加水鉴别物质种类。教师强调体现控制变量思想和明确加入水的量,并引导学生动手实验探究。
[总结升华]同学们最先提出了用化学方法进行定性的检验,现在我们又尝试了用物理方法进行定量的检验,这说明定性和定量的方法、不同学科的视角都能帮助我们解决问题,即使是同一个问题也可以用不同的思路去解决。
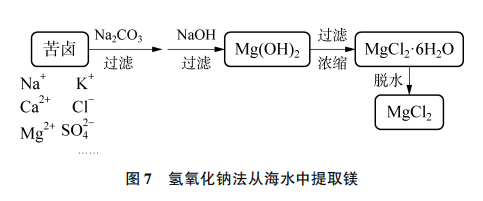
5.2 制盐有“术”:设计制取和从海水中提取氯化镁的方案
[回顾旧知]在我们之前所学的化学知识中,又可以通过哪些方法制取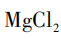 呢?请同学们尽可能选用不同类别的反应物制取
呢?请同学们尽可能选用不同类别的反应物制取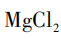 。
。
[交流反馈]
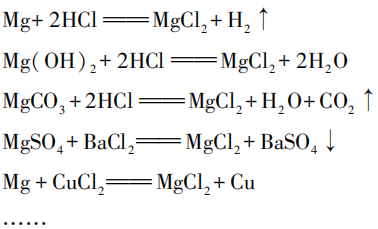
(学生说出方案的时候,让学生说出反应物的物质类别)
[提问]同学们怎么想到这么多方案的?
[学生回答1]想到复分解反应的特点是两个化合物互相交换成分,而且反应前后元素种类不变,所以就在思考,哪些物质含镁元素,哪些物质含氯元素,可以满足条件发生反应。
[学生回答2]氯化镁属于盐,盐和盐反应能生成盐,盐和碱反应能生成盐。然后根据物质类别猜想具体哪些物质可以发生反应。
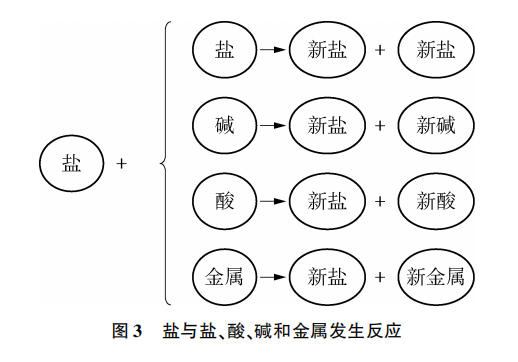
[小结]盐的化学性质:盐能与酸、碱、盐和金属发生反应(见图3)。
[过渡]我们写出了那么多方案,其实在实际工业中要节约成本,如果反应物(原料)的价格超过了生成物(产品)的价格,就不会有人愿意去生产了。从原料看,金属镁价格最高,碳酸镁、硫酸镁等的价格较低,但仍然比氯化镁贵。但是,我们参考表2的资料,海水晒盐的过程中,一部分以氯化钠形式析出,剩下的母液,我们称之为苦卤,其中含有丰富的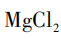 ,可以进一步利用。你能完善海水中提取
,可以进一步利用。你能完善海水中提取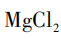 的方案(见图4)吗?
的方案(见图4)吗?
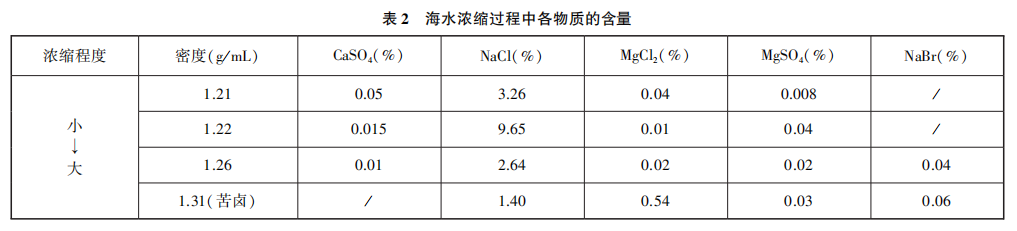
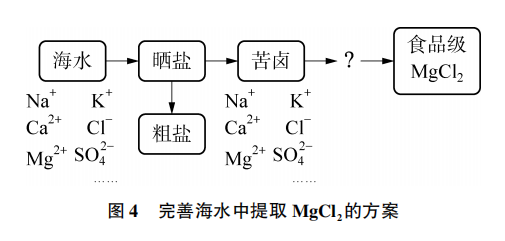
[学生活动]学生以小组为单位进行交流讨论。首先讨论了除杂的方式,钠离子和钾离子难以沉淀形式除去,所以可以将所需离子沉淀出来。学生提出将苦卤中的镁离子转化为碳酸镁或氢氧化镁。
[资料展示]20℃时,不同含镁化合物的溶解度: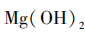 溶解度0.00064g,
溶解度0.00064g,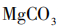 溶解度0.01g,
溶解度0.01g,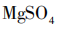 溶解度33.7g,
溶解度33.7g,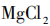 溶解度54.6g。
溶解度54.6g。
[学生回答]将苦卤中的镁离子转化为氢氧化镁更合适,可以加氢氧化钠或氢氧化钙。
[追问]本质上是利用碱溶液中的什么与苦卤中的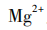 反应生成沉淀?
反应生成沉淀?
[学生回答] 。
。
[过渡]本质上就是离子之间的相互作用。
[资料展示]氢氧化钠和氢氧化钙的最新价格(在相关网站上查阅两种物质的最新价格)。
[追问]同学们,从成本角度考虑,你们会选择氢氧化钠还是氢氧化钙?
[学生回答]氢氧化钙。
[追问]由于氢氧化钙微溶于水,溶液中氢氧化钙含量较少,所以工业上一般不选用澄清石灰水,而是选择含氢氧化钙较多的什么物质?如何制得?
[学生回答]石灰乳。可用生石灰和水反应。
[追问]生石灰如何制得?
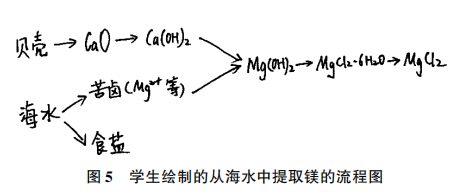
[学生回答]可以高温煅烧石灰石或贝壳,海边贝壳很多,用贝壳成本更低。学生画出了图5所示的流程图:用贝壳煅烧制得生石灰,进一步制得熟石灰。随后将镁离子进行沉淀过滤,后加盐酸,结晶析出,制得氯化镁。
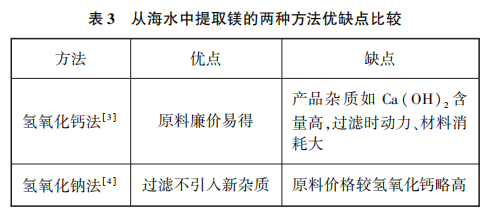
[提问]实际工业生产中,在沉淀池中获取氢氧化镁的同时也会引入氢氧化钙,在过滤工序中工艺动力和材料消耗较大,需消耗一定的成本。老师通过查阅资料,发现有工厂依旧选择价格较高的氢氧化钠,但却可以尽量避免后续杂质进入沉淀池(见表3)。
[提问]氢氧化钠法中为了防止后续有氢氧化钙的生成,加入碳酸钠除去钙离子,你觉得可不可行?
[学生回答]碳酸钠中的碳酸根可以同时与钙离子和镁离子反应。
[过渡]工业生产有窍门的!其实该工艺通过改变反应条件,尽可能除尽钙离子,同时减少镁离子的损耗。请同学们看看下列哪组实验中脱钙条件更优(见表4)?
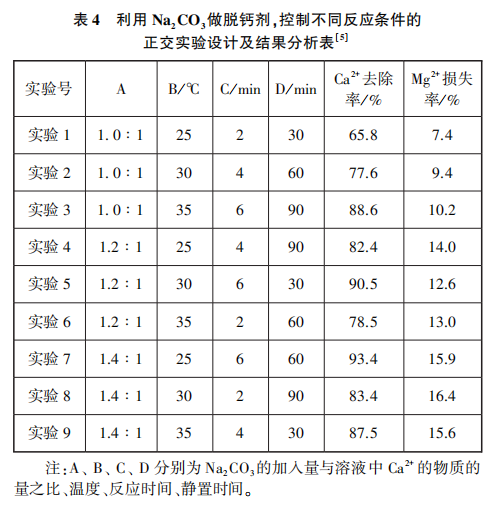
[提问]面对这么多数据,眼花缭乱,你最想关注哪组数据?
[学生回答]钙离子去除率和镁离子损失率。
[追问]哪几组数据较好?
[学生回答]第五组和第七组。
[追问]这两组数据,同学们通过对比分析,关注其他变量,每组的优点各是什么?
[学生回答]第5组的优点是:①消耗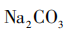 少,成本低;②静置时间短;③
少,成本低;②静置时间短;③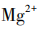 损失率更低。第7组的优点是:①温度略低;②
损失率更低。第7组的优点是:①温度略低;②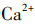 去除率略高。
去除率略高。
[追问]以去除钙离子为核心,综合考虑多方面因素,哪个方案更好呢?
[学生回答]第5组。
[提问]此工艺在实验5方案基础上进一步优化,将反应温度从原来的30℃改为25℃,请问下列哪个反应时间作为脱钙条件更优(见图6)?
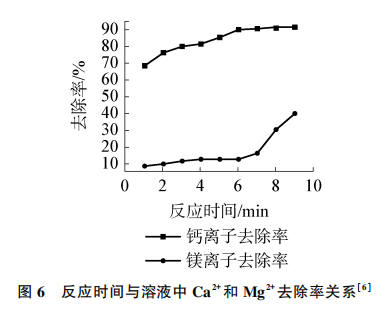
[学生回答]6分钟。
[教师归纳]在上述反应条件下利用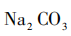 中
中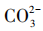 尽可能除钙离子,再利用NaOH中
尽可能除钙离子,再利用NaOH中 提取镁离子,通过一系列反应最终制得
提取镁离子,通过一系列反应最终制得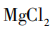 (见图7)。
(见图7)。
我们可以发现,改变或控制条件,可以使反应向更有利方向进行。生产生活中的工艺流程是复杂的,需要考虑的因素有很多,我们需要用变化的眼光去分析、解决问题,这也是我们学习化学的意义之一。
5.3 选盐有“悟”:分析不同盐类凝固剂制作的豆腐应用价值
[师生互动]现在静置时间结束,请同学们打开盖子,看看你们点卤成功了没?这其实就是我们平时吃的豆腐花。请同学们把点卤后的成品拿到讲台上来,感兴趣的同学可以课后与老师一起压制豆腐,需要1-2小时,后续我会将成品豆腐再交给同学们。
[豆腐展示]同学们,选择不同的盐,可以制成不同种类的豆腐,老师今天早上也利用氯化镁凝固剂做了豆腐,同学们看一看。以氯化镁为凝固剂制成的豆腐,在我们生活中叫北豆腐,也就是老豆腐,适合煎、焖、炒。而以硫酸钙为凝固剂制成的豆腐,在我们生活中叫南豆腐,软嫩细腻,适合烧着吃,做豆腐汤等。
[提问]我们可以通过豆腐摄取蛋白质,但是不同豆腐中蛋白质含量是不一样的,如果要摄取更多蛋白质应食用哪种豆腐?如果要摄取更多钙元素呢(见表5)?
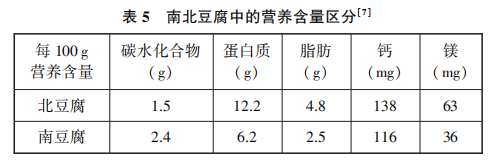
其实现在市场上的豆腐种类,远不止这两种,同学们课后可以去了解更多的知识。
[提问]今天,我们围绕盐讨论了很多化学变化,你能否总结归纳盐的化学性质呢?
[学生活动]学生讨论回答,结合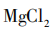 鉴别和制取方案交流反馈。
鉴别和制取方案交流反馈。
[小结]盐与酸、碱、盐和金属发生反应。盐的性质多样,所以在生活中具有很多广泛的用途,比如卤水、化肥等。普通的黄豆,脱去坚硬的外壳,粉碎成渣,稀成了汁,竟然能以豆渣、豆浆、豆腐等多种方式出现在我们的生活中,再经历了蒸炒煎炸尝尽酸甜苦辣咸后,便成了一道道可口的美食,发挥了它的大作为,而我们也要在不同的环境中不断磨练自己,带着这份持之以恒和吃苦耐劳的精神,也定能成就自己的大作为!
文章来源:中国知网
文章原名:《初中化学“盐”复习课探究式教学——以“探究豆腐制作中的点卤剂”为例》,文章有删减
作者:宋伟 江苏省江阴市教师发展中心